要点
- 双性イオンポリマー(PSPB)によるタンパク質凝集阻害の複雑な分子メカニズムを先駆的に解明した。
- PSPBは、多様なタンパク質の熱凝集に対して高い保護活性を持ち、PSPBとタンパク質の相互作用を実験及びシミュレーションにより包括的かつ詳細に検討した結果、弱く可逆的な結合の重要性を明らかにした。また、PSPBはタンパク質と弱く可逆的に相互作用することで、凝集経路を妨げ、凝集性中間体の形成を阻止することも明らかとなった。
- タンパク質治療薬の安定化と長期保存を実現する可能性を見出した。
- 将来的にはアルツハイマーなどの神経変性疾患の治療への応用も期待される。
概要
北陸先端科学技術大学院大学 物質化学フロンティア研究領域の松村和明教授、ラジャン・ロビン元助教およびZHAO Dandan研究員(超越バイオメディカルDX研究拠点)は、東京工業大学 生命理工学院 生命理工学系の古田忠臣助教と共同で、双性イオンポリマーによるタンパク質凝集阻害メカニズムの解明に成功した。
本研究グループが合成したスルホベタインポリマーと呼ばれる双性イオン高分子[用語1]は、タンパク質と弱く可逆的に相互作用し、凝集経路を妨げることで凝集性中間体の形成を阻止し、有害な凝集を防ぐ。この画期的な発見は、タンパク質治療薬を進歩させ、タンパク質のミスフォールディングに関連する様々な症状に対する新規治療法を開発する上で、計り知れない可能性を秘めている。
本成果は、2024年5月30日11時(米国東部標準時間)にCell Press発行「Cell Reports Physical Science」オンライン版に掲載された。
背景
タンパク質の凝集は、アルツハイマー病、パーキンソン病、ハンチントン病などの神経変性疾患の主な原因とされている。また、タンパク質医薬品の生産と保管中に凝集が発生すると、薬剤の活性と有効性が失われる可能性がある。従来の方法では、これらの凝集を防ぐことは困難であり、効果的な安定化手法の開発が求められていた。
研究内容
本研究グループは、双性イオン高分子の一種であるスルホベタインポリマー(PSPB)及びその疎水性誘導体がタンパク質凝集を抑制するメカニズムを解明した(図1)。PSPBはタンパク質と弱く相互作用し、凝集経路を妨げることで凝集性中間体の形成を阻止する。実験により、PSPBがインスリンやリゾチームなどの複数のタンパク質を熱ストレスから効果的に保護することが示された。特に、疎水性残基を導入したPSPBは、タンパク質の凝集抑制効果が著しく向上することが確認された。この効果は分子シールディング効果[用語2]と呼ばれ、保護対象のタンパク質と保護高分子が可逆的な相互作用を示すことにより、物理的に凝集を妨げている様子が分子動力学シミュレーション[用語3]の結果からも確認された。

図1. 各種合成した双性イオンポリマー
スルホベタインポリマー(PSPB)にブチルメタクリレート(BuMA)、ヘキシルメタクリレート(HxMA)、オクチルメタクリレート(OcMA)を共重合したポリマーの構造を示す。
主な結果
- PSPBの合成と特性評価:異なる疎水性モノマー(BuMA、HxMA、OcMA)を組み込んだ種々のスルホベタインポリマー(PSPB)を合成し、その特性を評価した。
- タンパク質の保護効果:インスリン、リゾチーム、乳酸脱水素酵素(LDH)をモデルタンパク質として使用し、PSPBがこれらタンパク質の凝集繊維形成を著しく抑制することを確認。分子量と疎水性が高いPSPBは、特に効果的であることが示された(図2)。
- 分子動力学シミュレーション:PSPBが分子シールドとして機能し、タンパク質分子間の距離を保ち、凝集を防ぐ効果を持つことが確認された(図3)。
- メカニズムの解明:熱分析、分光学的手法などを駆使し、PSPBによる凝集抑制効果の解明に成功した。モデルタンパク質のインスリンを加熱すると、タンパク質の高次構造がほどけるアンフォールディングが起こる。その後、さらに加熱することで凝集性の前駆体が形成され、不可逆な凝集体となる。ここにPSPBが存在することで、アンフォールディングする温度が高温側にシフトし、凝集前駆体の形成が阻害される。冷却時にはPSPBは脱離し、元の高次構造が維持される(図4)。PSPBへの疎水基の導入は、タンパク質の疎水性残基との相互作用を高める効果があり、より凝集前駆体の形成阻害効果を高めていることが示唆される。

- 図2.
- インスリン溶液の凝集抑制の様子。i)加熱前、ii)加熱後、iii)PSPB添加後に加熱。 加熱することで凝集により白濁していることが確認される。一方、PSPBを添加することで白濁は抑えられる。
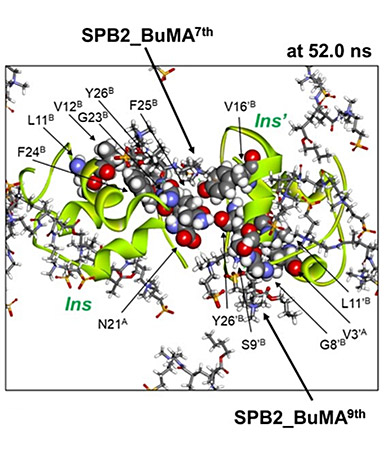
- 図3.
- P(SPB-r-BuMA)のモデルとしたスルホベタイン2量体にブチルメタクリレートを結合した化合物(SPB2_BuMA)とインスリンのMDシミュレーションによるスナップショット。インスリン二分子の間にモデル化合物が分子シールドとして可逆的にサンドイッチされ、凝集を妨げている様子が見られた。
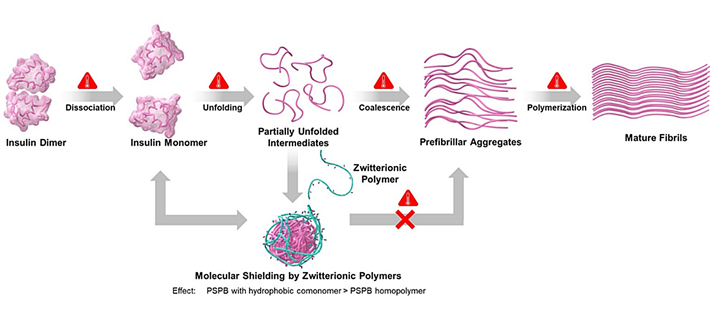
- 図4.
- 凝集抑制メカニズムの模式図。インスリン二量体(天然構造)が加熱により単量体に変性し、さらにアンフォールディングして立体構造が解消される。その際にポリマーがあると、分子シールディング効果により、凝集前駆体の形成を抑制し、繊維状凝集前駆体(prefibrillar aggregates)から繊維凝集体(mature fibrils)の形成を阻害する。
今後の展望
PSPBによるタンパク質凝集抑制効果の分子メカニズムに迫った研究は初めてであり、このメカニズムにより、PSPBがタンパク質治療薬の安定化と長期保存に貢献できる可能性が示された。
さらに、この研究は新しい診断及び治療法の開発にも応用される可能性があり、将来的には幅広い疾患に対する効果的な治療法の提供が期待される。本研究グループは、今後さらにアミロイドβタンパクの凝集抑制などの研究を進め、アルツハイマー病やパーキンソン病などのタンパク質凝集が原因とされる神経変性疾患の治療や原因解明など、実用化に向けた具体的な応用方法の開発に取り組んでいく予定である。
付記
本研究は、科学研究費助成事業 基盤研究(B)20H04532、若手研究20K20197、23K17211、学術変革領域研究(A)21H05516、国立研究開発法人科学技術振興機構(JST)研究成果最適展開支援プログラム(A-STEP)JPMJTR20UN、文部科学省ナノテクノロジープラットフォーム事業JPMXP09S21MS1051、JPMXP09S21MS1051b、文部科学省マテリアル先端リサーチインフラ事業JPMXP1222MS1007、ならびに北陸先端科学技術大学院大学超越バイオメディカルDX研究拠点、生体機能・感覚研究センターの支援のもと行われた。
用語説明
[用語1] 双性イオン高分子 : 同一分子内に正電荷と負電荷を持つ全体としては中性の高分子で、高い水和性と低い非特異的タンパク質吸着性を持つ。これにより、生体適合性が高く、医療分野やバイオテクノロジー分野で広く研究、応用されている。
[用語2] 分子シールディング効果 : Tunaccliffeらの報告によると、ある種の天然変性タンパク質が乾燥時に他のタンパク質の周りに保護相を形成し、物理的に凝集を抑制する効果のことを分子シールディング(molecular shielding)効果として説明している。(Chakrabortee S, et al., Mol. Biosys. 2012, 8, 210-219)
[用語3] 分子動力学シミュレーション : 分子系の運動を時間的に解析する手法。具体的には、原子や分子の初期位置と速度を設定し、相互作用ポテンシャルを用いてニュートンの運動方程式を解くことで、分子系の時間発展を追跡し、構造変化、相転移、拡散などの現象を解析する。例えば、タンパク質のフォールディング過程や薬物分子の結合動態、材料の熱物性などを詳細に調べることができ、生物学、化学、材料科学に広く応用されている。
論文情報
掲載誌 : |
Cell Reports Physical Science |
論文タイトル : |
Molecular mechanism of protein aggregation inhibition with sulfobetaine polymers and their hydrophobic derivatives |
著者 : |
Robin Rajan, Tadaomi Furuta, Dandan Zhao, Kazuaki Matsumura |
DOI : |
- プレスリリース 革新的ポリマーを用いたタンパク質凝集阻害メカニズムの解明 —タンパク質医薬品製造の効率化や神経変性疾患治療への応用に期待—
- Aqp10タンパク質の尿素・ホウ酸輸送活性の減弱が生じた進化上のタイミングを同定|東工大ニュース
- 細胞と細胞をつなぐ分子の結合過程の撮影に成功|東工大ニュース
- 世界最小サイズの発光酵素picALuc®の開発に成功|東工大ニュース
- 動いて並んでつながって。タンパク質が幾何学模様に!|東工大ニュース
- 人工シャペロンにより脂質二重膜の2次元/3次元構造の高効率で可逆的な変換に初めて成功|東工大ニュース
- キチン加水分解酵素は熱ゆらぎを利用して一方向に動きながら結晶性バイオマスを分解する分子モノレールカーである|東工大ニュース
- 古田忠臣 Tadaomi Furuta|研究者検索システム 東京工業大学STARサーチ
- 生命理工学院 生命理工学系
- 北陸先端科学技術大学院大学
- 研究成果一覧
お問い合わせ先
北陸先端科学技術大学院大学 物質化学フロンティア研究領域
教授 松村和明
Email mkazuaki@jaist.ac.jp
Tel 0761-51-1680
東京工業大学 生命理工学院 生命理工学系
助教 古田忠臣
Email furuta@bio.titech.ac.jp
Tel 045-924-5776
取材申し込み先
北陸先端科学技術大学院大学 広報室
Email kouhou@ml.jaist.ac.jp
Tel 0761-51-1031
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661

