要点
- 生細胞内で開裂する架橋剤を用いた新概念の刺激応答性蛍光ナノ粒子
- 従来型の蛍光微粒子と異なり蛍光造影による診断のバックグラウンド補正不要
- 薬が放出される場所や徐放速度を確認できるドラッグデリバリーシステム
概要
東京工業大学大学院理工学研究科の仁子陽輔研究員、小西玄一准教授らは、細胞外では発光せず、細胞に取り込まれると発光する新概念の蛍光性ナノ粒子を開発した。1分子で独立していると発光し、凝集すると消光する蛍光色素(ナイルレッド)を、界面活性剤を使って凝集、固定して非発光性とし、生細胞内の還元条件の刺激によって凝集を解いて強力な蛍光を発光させる仕組み。
これを標的細胞のイメージング(診断)の造影剤に用いると、細胞外ではほぼ無発光のため、観察対象のみが色づけされる。これまでの蛍光微粒子とは異なり、バックグラウンド補正なしで観測が可能となる。またドラッグデリバリーシステム(DDS)への応用も有効だ。生細胞中で微粒子が分解する様子が蛍光で観察できるため、発光と同時に起こる薬の放出場所や徐放速度が追跡可能となり、薬の処方量の低減や患部だけを狙った薬の開発に貢献する。
近年、蛍光性のナノ粒子を用いたイメージングは、X線、MRIなどに替わる新手法として盛んに研究されているが、実用化の障害の一つとして、細胞内に取り込まれていないナノ粒子から発生する不要な蛍光により、診断したいサンプルの観察の精度が落ちるという問題があった。
この研究はフランス・ストラスブール大学薬学部との共同で、欧州化学連合のジャーナルであるケミストリー・ヨーロピアン・ジャーナル(Chemistry an European Journal)に掲載された。
研究の背景
近年、医学分野では病気の迅速かつ正確な診断が求められており、リアルタイムで実施できる「分子イメージング」に大きな注目が集まっている。また生命科学分野では、細胞内で起きる現象の解明に、見たい部分だけを色づけして追跡する高精度な観察が必要とされている。2014年のノーベル化学賞は、細胞内にある小器官の構造やタンパク質の移動の観察を可能にした超高解像度顕微鏡の開発に与えられた。また、下村脩博士が受賞した2008年の同賞は、細胞内で起こる生命現象を可視化する緑色蛍光タンパク質が対象だった。
近年、さらなる高性能化と実用化に向けたコストダウンが求められており、中でも蛍光性ナノ粒子(有機系のミセル、ナノ油滴、デンドリマーなど)の利用が盛んになっている。この方法は、(1)生体組織の非破壊的かつリアルタイムなイメージングが可能、(2)他のイメージング法(MRIやX線など)と比べ安価に実施できる、(3)ナノ粒子中に多数の蛍光分子を含むため、単一分子で染色する方法より高感度である、(4)無機系ナノ粒子(量子ドット)と比べ細胞毒性が小さい―といった利点がある。しかし、これまで知られている有機系蛍光ナノ粒子は、光安定性、安全性が十分でないものや、細胞に取り込まれていない粒子の発光による観察の阻害が起こるなど、実用に向けて改善・解決すべき問題が多数指摘されていた。
研究成果
細胞内で分解し強発光する刺激応答型蛍光ナノ粒子
仁子研究員らは、これらの問題点を克服するために刺激応答型蛍光ナノ粒子というコンセプトを提案した。それは、細胞に取り込まれる前には発光せず、細胞内の環境中で分解して発光するという発光のon・off機能(刺激応答性)を有するナノ粒子である。この方法を使うと、観察対象の細胞だけを選択的にイメージング(染色)することができる。(図1)
ミセルと蛍光分子の特徴を生かした刺激応答型ナノ粒子
新コンセプトのナノ粒子は、ミセルと蛍光分子の特徴が巧みに組み合わされてできたものである。
ミセルは、石鹸のように親水部分と疎水部分から成る分子が水中で会合して外部に親水部分、内部に疎水部分が揃った球状のナノサイズの集合体。ミセルは合成が簡便で、疎水性の薬を封入するのに優れておりドラッグデリバリーシステムへの応用研究が進んでいる。今回の研究では、すでに知られている生体適合性に優れたミセルを細胞内の還元条件下でのみ分解する架橋剤を用いて固定した刺激応答型ナノ粒子を作製した。
刺激に応答して発光する材料の設計では、ある蛍光色素が一分子で独立していると発光し、凝集すると消光するという性質を利用した。蛍光色素を疎水部に導入した界面活性剤を水中に入れると、ミセルを形成し、内部で色素が凝集して発光しない。このミセルを細胞内で分解して色素の凝集を解くと、強発光性を示す。
実際の分子イメージング
今回はナイルレッドという赤色発光色素を用いて界面活性剤を作製、非発光性のミセルを作製した(図1(1))。次に、生細胞に内在する還元剤であるグルタチオンによって分解する架橋剤を用いてミセルを固定化し、非発光性のナノ粒子を得た(同(2))。実際に生細胞内に取り込まれると、分解が始まり、細胞をイメージングすることができる(同(3))。
図2に示すように、細胞内でのみ発光することが定量的に示されており、細胞内に取り込まれていないナノ粒子から発生する不要な蛍光が観察の邪魔をしていない。この水準のイメージングになると、バックグランドの補正の必要がなく、精度の高い診断を行うことができる。
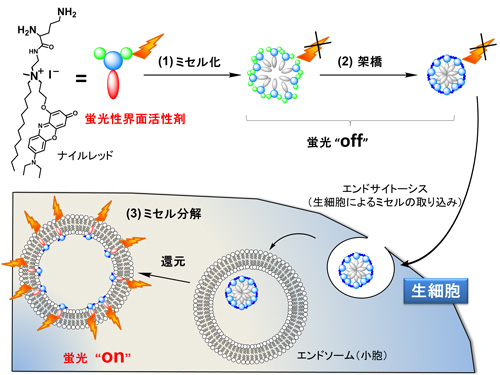
図1. 刺激応答型ミセルの開発コンセプト
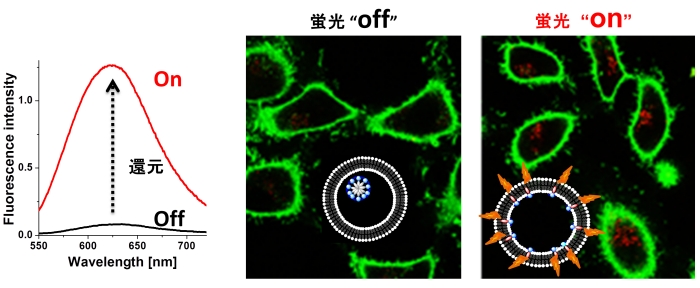
図2. 還元剤の添加前後における蛍光ナノ粒子の発光オン・オフ挙動(左)とAFMによるAFMの画像(右)
薬の放出を観察することができるドラッグデリバリーシステムへの期待
この蛍光ナノ粒子を、薬を患部まで運んでから放出するドラッグデリバリーシステムに応用すれば、薬が患部に到達していることの確認と薬の放出する様子をリアルタイムで観察することが可能になる。操作は簡単で、ナノ粒子を作る際にミセル内に薬を入れておき、架橋して封じ込めるだけだ。
薬が患部まで届いていることの確認ができ、薬の放出速度を蛍光発光の変化から算出することができれば、薬の処方量が最適化でき、副作用を最小限に留めることができる。現在、研究は医学への応用へと進んでいる。
この研究は、文部科学省の「研究大学強化促進事業」を活用した東工大の「国際的な共同研究推進のための派遣・招へい支援プログラム」および日本学術振興会(JSPS)の科学研究費補助金(特別研究員)などの支援を受けて行った。
論文情報
掲載誌 : |
Chem. Eur. J. 20, 16473-16477 |
論文タイトル : |
Disassembly-Driven Fluorescence Turn-on of Polymerized Micelles by Reductive Stimuli in Living Cells |
著者 : |
Yosuke Niko, Youri Arntz, Yves Mely, Gen-ichi Konishi, Andrey S. Klymchenko
|
DOI : |
問い合わせ先
大学院理工学研究科 有機・高分子物質専攻
准教授 小西玄一
Email: konishi.g.aa@m.titech.ac.jp

