要点
- DNA相同組換えの中心であるDNA鎖交換反応をリアルタイムで観察
- 触媒のRad51リコンビナーゼが相同配列を見つけて、DNA鎖を交換するしくみを解明
- DNA鎖交換反応の分子機構のシミュレーションに成功
概要
東京工業大学 科学技術創成研究院 細胞制御工学研究センターの岩﨑博史教授、伊藤健太郎研究員、同大学 生命理工学院 生命理工学系のTAKAHASHI MASAYUKI特任教授、国立遺伝学研究所の村山泰斗准教授、横浜市立大学の池口満徳教授、理化学研究所の美川務専任研究員らの研究グループは、DNAの相同組換えの中心的な反応であるDNA鎖交換の反応機構を明らかにした。
相同組換えは、DNA二重鎖切断[用語1]を正確に修復する生理機能であり、遺伝情報の維持や遺伝的多様性の創出にかかわる重要な生命現象である。その中心であるDNA鎖交換反応では、似た配列、すなわち、相同な配列を持つ2組のDNA間で鎖を交換する。この反応はRad51リコンビナーゼ[用語2]によって触媒されることが知られているが、Rad51リコンビナーゼが相同配列を見つけてDNA鎖を交換するしくみは不明であった。
今回の研究では、DNA鎖交換反応をリアルタイムで観察し、Rad51リコンビナーゼがDNA鎖を交換する反応過程の詳細を明らかにした。さらに、その反応の実際の分子構造をシミュレーションすることに世界で初めて成功した。今回の成果により、相同組換えによるヒトがん抑制の分子機構研究にさらに弾みがつくことが期待される。
この成果は、6月11日付けの『Nature Communications』に掲載された。
背景と経緯
私たちの体の中にあるDNAは様々な種類の損傷を、細胞1個あたり1日に約10万ヵ所も受けている。なかでもDNAの二重鎖切断は特に重篤な損傷であり、細胞死やがんの引き金となることが知られている。相同組換えはこのDNA二重鎖切断を正確に修復する生理機能であり、すべての生命に普遍的に備わっている。
Image may be NSFW.
Clik here to view.
図1. 相同組換えによるDNA二重鎖切断修復のモデル
相同組換えは多段階の反応が組み合わさって進行する複雑な生命現象である。そのなかで特に重要なステップが、Rad51リコンビナーゼによって触媒されるDNA鎖交換反応である(図1)。この反応では、Rad51リコンビナーゼがDNA二重鎖切断の末端に生じた一本鎖DNA上でらせん状に結合して、フィラメント状の核酸タンパク質複合体を形成する。そのうえで、無傷の二重鎖DNAを捕捉して、相同なDNA配列の検索を行う。相同配列が見つかると、二重鎖DNAが巻き戻されて[用語3]フィラメント中の一本鎖DNAと対合し(DNA鎖交換)、新たな二重鎖DNA (これを「ヘテロ二重鎖DNA」と呼ぶ)ができる。
こうしたフィラメントについて、10分子からなるRad51(白と灰色)が一本鎖DNA(緑色)に結合した場合の立体構造モデルを図2に示した。Rad51リコンビナーゼはDNA結合部位[用語4]を2ヵ所持っている。そのうち第1結合部位は、第1ループ(loop 1:青色の領域)と第2ループ(loop 2:赤色の領域)の2つのループで構成されており、第2結合部位(黄色のアミノ酸残基)は一本鎖DNAから少し離れた場所に位置している。注目すべきは、第1結合部位の2つのループが一本鎖DNAを挟み込んでいる点である。これまで様々な解析が行われてきたが、これらのDNA結合部位が、どのように相同DNA配列の検索とDNA鎖の交換を行っているかは不明であった。
Clik here to view.
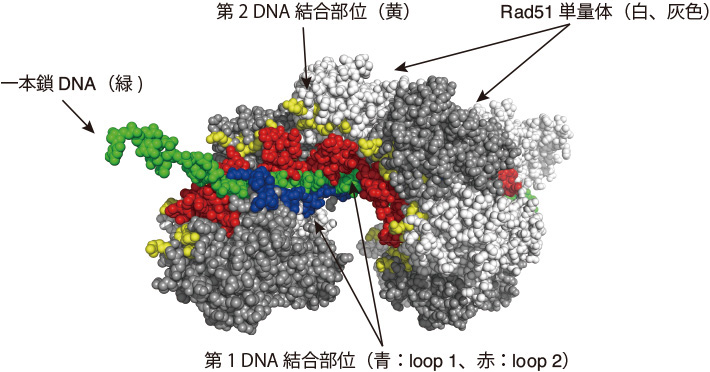
- 図2.
- Rad51・一本鎖DNAフィラメントの立体構造モデル。Rad51単量体を、白または灰色の球を用いた空間充填モデルで表した。それぞれの分子の第1 DNA結合部位中のloop 1を青色、loop 2を赤色で表すと、一本鎖DNA (緑色)を挟む配置をとる。第2 DNA結合部位は黄色で示した位置にあり、一本鎖DNAからは少し離れていることがわかる。このモデルでは10分子からなるRad51が一本鎖DNA上にらせん状に結合したフィラメントを表しているが、実際の細胞内では数千個ものRad51分子が一本鎖DNAに結合し、フィラメント構造を形成すると考えられている。
研究成果
岩崎研究室では、蛍光共鳴エネルギー移動(FRET)[用語5]を利用して蛍光標識したDNA鎖の交換反応をリアルタイム解析し、反応機構を研究している。これまでに、Rad51リコンビナーゼによるDNA鎖交換反応が、次の3つのステップで進行することを見出していた。(1)Rad51・一本鎖DNAフィラメント複合体が二重鎖DNAを捕捉して、反応中間体C1を形成する。(2)相同配列が見つかると、DNA鎖が交換されて「ヘテロ二重鎖DNA」を持つ反応中間体C2に移行する。(3)反応中間体C2が解消されて反応が完了する。
今回の研究では、このFRETを利用した方法による、分裂酵母Rad51リコンビナーゼのDNA結合部位の変異体のリアルタイム解析から、上記の反応ステップにおける重要な素反応とDNA結合モチーフの役割を明らかにした。(1)Rad51・一本鎖DNAフィラメント複合体は、Rad51の第2 DNA結合部位を用いて二重鎖DNAを捕捉し、その結果としてC1中間体が形成される。(2)loop 1が二重鎖DNAと結合することによって、C1中間体が形成・安定化される。(3)相同DNA配列が見つかると、loop 2によってDNA鎖交換が促進され、C1中間体からC2中間体へ遷移する(図3)。
Clik here to view.
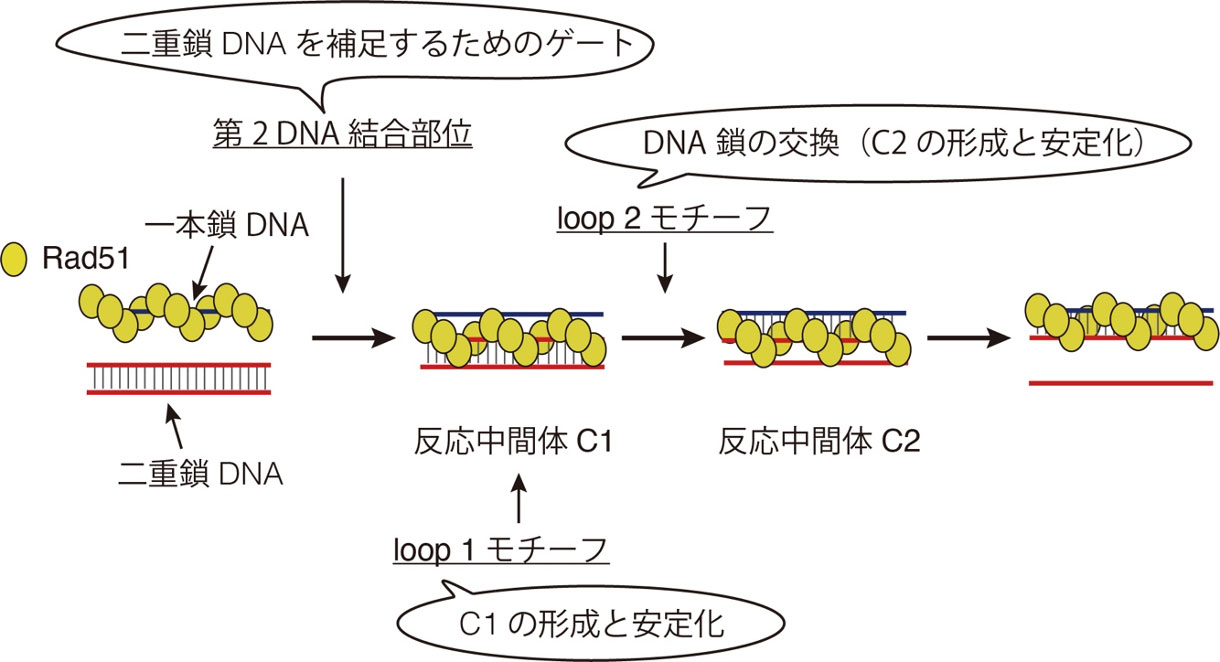
図3. DNA鎖交換反応におけるRad51リコンビナーゼのDNA結合モチーフの役割
この結果に基づいて、DNA鎖交換反応における、活性中心を形成するアミノ酸残基とDNA鎖の動きをシミュレーションした(図4)。リコンビナーゼタンパク質内の活性中心で起こっているDNA鎖交換反応の実際の分子機構をシミュレーションしたのは世界初である。
Image may be NSFW.
Clik here to view.
図4. DNA鎖交換反応における、DNA鎖と活性中心を形成するアミノ酸残基のシミュレーション
R257はloop 1に存在する鎖交換活性に重要な残基、V295はloop 2に存在する鎖交換活性に重要な残基、site IIは第2 DNA結合部位を形成する2つの重要なアミノ酸を示している。Rad51の単量体をA、 B、 Cで表しており、「R257_A」は「AサブユニットのR257残基」を指す。最初に形成されるRad51・一本鎖DNAフィラメントが二重鎖DNA(青色と緑色の鎖からなる二重鎖)を捕捉し、最初のC1複合体を形成する。その後、鎖を交換してヘテロ二重鎖(赤色と青色の鎖からなる二重鎖)を含むC2複合体ができ、最終的に、一本鎖DNA(緑色)を放出して、Rad51・二重鎖DNAフィラメントが形成される。
今後の展開
相同組換えにおけるDNA鎖交換反応の分子機構は、Rad51の立体構造が決定されているにもかかわらず、不明のままだった。今回の研究成果は、バクテリアからヒトまで保存されているDNA鎖交換反応の根本的な分子機構を解明したもので、その普遍性から学問的価値が大きいといえる。
相同組換えの機能不全は、細胞死やガン発生の引き金になることが知られており、医学的にも重要な課題である。今回、分裂酵母Rad51リコンビナーゼによるDNA鎖交換の反応原理が明らかになったことで、相同組換えによるヒトがん抑制の分子機構研究にさらに弾みがつくことが期待される。
用語説明
[用語1] DNA二重鎖切断 : DNAは2本のポリヌクレオチド鎖(1本鎖DNA)がお互いに巻きついた二重らせん構造をしている。放射線や化学変異原に曝露すると、その鎖が切断されるが、切断箇所が近いと、両方の鎖が分断され、二重鎖切断となる。
[用語2] Rad51リコンビナーゼ : DNA鎖交換反応を触媒する酵素。バクテリアからヒトまで保存されている。すべての生物種に存在する。バクテリアの酵素はRecA、酵母やヒトなどの真核細胞ではRad51とよばれている。
[用語3] DNAの巻き戻し : DNAは2本の鎖が巻き戻されると1本鎖DNAとなる。1本鎖DNAに相補的な鎖があると、巻きついて再び二重鎖DNAを形成することができる。
[用語4] DNA結合部位 : タンパク質上の特定のアミノ酸残基がDNAと結合する。この部位をDNA結合部位という。
[用語5] 蛍光共鳴エネルギー移動(Fluorescence resonance energy transfer:FRET) : 2つの蛍光分子が近接して存在している時、供与体となる蛍光分子から受容体となる蛍光分子へ励起エネルギーが直接移動する現象。
論文情報
掲載誌 : |
Nature Communications |
論文タイトル : |
Real-time tracking reveals catalytic roles for the two DNA binding sites of Rad51 |
著者 : |
Kentaro Ito, Yasuto Murayama, Yumiko Kurokawa, Shuji Kanamaru, Yuichi Kokabu, Takahisa Maki, Tsutomu Mikawa, Bilge Argunhan, Hideo Tsubouchi, Mitsunori Ikeguchi, Masayuki Takahashi & Hiroshi Iwasaki |
DOI : |
10.1038/s41467-020-16750-3 Image may be NSFW. Clik here to view.  |
- プレスリリース 相同なDNA配列間でRad51リコンビナーゼによるDNA鎖を交換するしくみを解明 —ヒトがん抑制の分子機構研究に弾み—Image may be NSFW.
Clik here to view.![PDF]()
- 相同組換えを活性化するメカニズムを解明|東工大ニュース
- 「がん遺伝子」として働くのか?組換え酵素Rad52が染色体異常を引き起こすことを発見|東工大ニュース
- 相同組換えのDNA鎖交換反応開始の分子機構を解明|東工大ニュース
- 分裂酵母の性(接合型)変換を制御する新たな遺伝子を発見│東工大ニュース
- 相同組換えのDNA鎖交換の素過程を世界で初めて解明|東工大ニュース
- 遺伝子撹拌装置をタイミング良く染色体から取り外す仕組み│東工大ニュース
- 葉緑体増殖の基礎的しくみを解明―葉緑体分裂・増殖時にDNA分配を制御する酵素の発見―│東工大ニュース
- DNA相同組換えの複雑な制御機構を解明 ―分裂酵母DNAヘリカーゼFbh1が多様な働き―│東工大ニュース
- 岩崎研究室 ―研究室紹介 #11―
- 岩崎研究室
- 研究者詳細情報(STAR Search) - 岩﨑 博史 Hiroshi Iwasaki
- 研究者詳細情報(STAR Search) - 伊藤 健太郎 Kentaro Ito
- 研究者詳細情報(STAR Search) - Masayuki Takahashi
- 科学技術創成研究院 細胞制御工学研究センター
- 科学技術創成研究院
- 生命理工学院 生命理工学系
- 国立遺伝学研究所
- 横浜市立大学
- 理化学研究所
- 研究成果一覧
お問い合わせ先
研究に関すること
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
教授 岩﨑博史
E-mail : hiwasaki@bio.titech.ac.jp
Tel : 045-924-5168 / Fax : 045-924-5207
情報・システム研究機構 国立遺伝学研究所 染色体生化学研究室
准教授 村山泰斗
E-mail : ystmurayama@nig.ac.jp
Tel : 055-981–6810
横浜市立大学 大学院生命医科学研究科
教授 池口満徳
E-mail : ike@yokohama-cu.ac.jp
Tel : 045-508-7232
取材申し込み先
東京工業大学 総務部 広報・社会連携課
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661
国立遺伝学研究所 リサーチ・アドミニストレーター室 広報チーム
E-mail : infokoho@nig.ac.jp
Tel : 055-981-5873 / Fax : 055-981-9418
横浜市立大学 広報室
E-mail : koho@yokohama-cu.ac.jp
Tel : 045-787-2445
理化学研究所 広報室 報道担当
E-mail : ex-press@riken.jp
